[기고] 인도네시아 건강보조식품, 전통의약품 진출 시 고려 사항
페이지 정보
작성자 코트라자카르타무역관 쪽지보내기 메일보내기 자기소개 아이디로 검색 전체게시물 작성일19-05-30 11:04 조회1,174회 댓글0건본문
[기고] 인도네시아 건강보조식품, 전통의약품 진출 시 고려 사항
임준환 PT. Green Nature Farm 대표(jhlim9971@hanmail.net)
들어가며
인도네시아는 세계은행 2017년도 GDP 자료에 따르면 1조 달러를 넘고 있는 ASEAN에서 가장 큰 시장이다. 현재 동남아시아 중 한류 열풍의 전달이 제일 늦게 발현된 곳이기도 하지만 한류 드라마와 음악의 인기와 관심이 높아지면서 한국산 제품에 대한 관심과 구매도가 높아지는 추세이다. 일반적으로 화장품이 가장 먼저 떠오를 수 있으나 식품류나 건강보조식품제에 관심이 매우 빠른 속도로 증가하고 있는데, 이는 인도네시아 소비자 1인당 GDP의 상승으로 건강과 생활에 대한 관심과 소비가 증가했기 때문이다.
필자는 화장품, 생활 가정 기능성 용품, 미용용품, 가공식품, 건강보조식품분야 중 이번 기고에 건강보조식품에 대한 인도네시아 허가 관청이 식약청의 관련 분야 개요와 준비 요건, 주의 사항 그리고 건강 보조식품과 전통의약품의 인도네시아 수입 통관에 대해 안내하고자 한다.
현재 건강보조식품의 다양한 기능성 제품 개발로 해외시장 개척에 우리 기업들이 관심을 많이 가질 것으로 보인다. 그러나 인도네시아는 비관세 장벽이 제일 어려운 국가 중 하나로 이 중 1차 관문인 사전 제품 인허가에 등록 요건 충족과 준비가 어려운 것이 인도네시아 건강보조식품 수출 주요 애로사항이다. 평균 제품 등록기간이 8~16개월 소요되고 있다. 필자의 현지 경험으로는 이는 인도네시아 규정에 대한 이해와 사전 준비에서 오는 문제로 보고 있다. 실제 기본 요건을 충족해 준비한다면 BPOM 인증 준비기간 평균 최대 6개월 이내에도 인증 발급이 가능하다.
인도네시아 식약청(BPOM)의 유형 분류의 건강보조식품과 전통의약품의 개요
인도네시아 식약청은 등록 허가 유형의 구분으로 화장품(NA)/일반 가공식품(ML)/전문식품(ML)/건강보조식품(SI)/전통의약품(TI)/의약외품(QI)/일반 의약품/전문 의약품으로 나뉘며, 그 요구 기준에 충족해야 허가를 받을 수 있다. 이 중 일반의약품과 전문의약품은 인도네시아 제약면허를 보유한 기업만이 수입 허가를 받을 수 있어서 허가 요건을 갖춘 바이어사와의 거래 준비가 어렵고 많은 전문성이 요구되는바, 전문 컨설팅사를 통해 자문하거나 식약청에 문의를 해 보기를 권장한다. 본 기고에는 일반 수입 상사들이 주로 허가를 받을 수 있는 화장품에서 전통의약품/의약외품까지의 유형 중 건강보조식품과 전통의약품에 대하여 다루고자 한다.
건강보조식품과 전통의약품의 구분
건강보조식품은 비타민류나 미네랄류 및 아민류를 함유한 제품이 해당되며, 전통의약품은 인삼, 홍삼, 당귀, 천궁, 작약 등, 한국의 한약재 재료라 할 수 있다. 인도네시아는 오래전부터 천연 식물 약재의 사용이 많고 또 그 연구와 개발도 많은 편이어서 건강보조식품과 별개로 특이하게 전통의약품 유형이 있다. 다만 이런 전통의약품에 비타민류나 미네랄류, 아민류가 첨가될 경우에는 건강보조식품으로 분류된다.
물론 일반 가공식품에도 비타민류나 미네랄류, 아민류의 사용은 가능하다. 다만 일반 가공식품은 1일 섭취량과 또 그 사용 품목 수와 종류에 제한이 되어 있는 점에 유의해야 한다. 소량이라도 미네랄과 비타민류가 포함된다면 건강보조 식품류에 해당되어 건강보조 식품 등록 허가 요건에 맞추어 준비가 되어야 한다. 이런 요건의 분류 기준에 해당 제품에 대한 평가는 따로 사전에 인증 관련 전문가의 자문과 도움이 필요하다.
인도네시아 식약청인 BPOM 등록에는 제조사의 국가에서 평가받은 식품 또는 건강보조식품 등의 등급에 영향을 받지 않는다. 인도네시아에서는 위 설명과 같이 제품의 제조에 사용된 전 성분의 구성 사항에 따라 일반 식품-가공식품과 건강보조식품-전통의약품 등급을 나누어 접수와 심사 평가를 하고 있다. 이에 한국에서 기타 혼합 음료로 한국 식약처에 신고가 된 제품이라도 인도네시아의 위 기준에 따라 건강보조식품으로 등록을 진행해야 하는 어려움이 있다.
건강보조식품과 전통의약품의 등록 기본 요건
1. 인허가 서류
- 해외 제조품은 인도네시아의 기업이 위탁해 등록 업무를 위임하는 구조로 파트너사가 지정돼야 한다. -> Letter of Appointment(LOA)
- GMP: 한국 식약처의 발급 GMP가 인정 대상이나 한국의 경우 제약사 이외 건강보조식품 생산공장의 경우 health functional food로 기재해 GMP 인증서가 발급된다. 이 경우 인도네시아 식약청에서 SMF(site master file)를 추가 제출하고 이 SMF 서류의 평가를 거쳐 제조사를 인정받을 수 있다.
- CFS (Certificate of Free Sale) 자유판매 증명서를 한국 식약처로부터 발급받아 제출해야 한다.
* 참고로 위 GMP와 CFS는 한국 여의도 소재한 인도네시아 대사관 영사과에서 필히 공증을 받아 제출돼야 한다.
2. 제품의 기술 서류 및 포장 디자인
1) 제품 성분 함량표(Ingredients in percent): 영문 작성, active, non-active 재료 구분 표기
2) 재료 목록(Material list): 위 성분표의 기재 재료의 재료 구분, 재료 원천 등의 목록 필요
3) 각 재료에 대한 제품 시험검사성적서(COA) (주 재료 및 첨가제의 모든 재료의 COA)
4) 제조 공정도(제품별- 회사에서 사용하는 작업 지시서의 개념이 아님)
5) 완제품(등록 제품)의 제품 규격서 및 시험 성적서
6) 완제품의 시험 검사 성적서(COA): 미생물, 중금속 사항 이외 해당제품 신고 등급별 영양표시 성분과 assay 검사 대상을 확인해 검사 진행이 필요(인도네시아 공인 시험기관)
7) 안정보고서(Stability Report): 안정성 평가 보고서로 가속성 기준 최소 6개월 장기 최대 3년간 평가 보고서 작성 및 제출(신규 개발 제품도 최소 6개월간의 가속성 테스트 기준에 의거 준비 필요)
8) 포장 재료의 규격서(specification) 및 시험 성적서
9) 유효기간 설명서: 제품의 유효기간 설정 사유와 표기에 대한 설명
10) Batch No. 또는 LOT No.의 표기 설명서: 번호 구성에 대한 설명이 포함돼야 함.
11) 제품의 식용법(국문 경우 영문 자료 추가): 인니어 번역 의무
12) 제품의 포장 디자인(컬러판 평면도) 한글 포장제품의 경우 해당 한글의 번역본 필요
13) 포장 라벨링 표기 사항: 인니어로 라벨링 규정에 의거 의무 표시 사항 준비 필요.
인도네시아 식약청의 등록 요건 서류 준비에 가장 어려운 사항(문제점)
1. 우선 제조사는 필수적으로 GMP 허가를 받은 공장에서 제조품이 되어야 한다. 또는 OEM, ODM이 경제성 문제로 어려울 경우 일반 가공식품에 준하는 기준에 맞추어 레시피를 변경 생산해야 하는 문제가 있다.
2. GMP 허가 공장에서 생산제품일 경우라도 health functional food GMP, 즉 건강기능식품 GMP 허가 공장의 경우 SMF(site master file) 서류를 구성해 인도네시아 식약청에서 다시 평가를 받아 승인을 받아야 하는 문제가 있다. 이 SMF 구성은 WHO 규정에 근거해 구성돼야 하나 그 구성의 세부 내용이 평가되며, 이는 실제 BPOM 등록 지연 사유 중 가장 많이 발생하는 건이다.
3. 한국 제조 환경의 현실을 볼 때 기술 서류 중 안정 보고서(Stability Report) 준비는 인도네시아 요구 조건을 사전에 맞추어 준비가 되어 있는 제조업체는 없다고 본다. 이 Stability Report 내용에서 전 성분의 활성(active) 재료에 대한 순도 범위(Assay range) 평가에 최소 6개월에서 3년의 시험 검사 데이터가 포함되어야 하기 때문이다. 이에 인니 조건을 맞추기 위해 가속성 조건(Acceleration test: 40℃± 2℃/75±5% RH)에서 최소 6개월간 축적된 평가 자료가 보고서로 작성 제출되어야 한다. (참고 Long-term Test: 30± 2℃/75±5% RH)
이 Stability Report에 또 하나의 주의 사항은 순도(assay) 검사 대상은 범위의 안정성 부분의 확인을 위해 건강보조식품과 전통의약품은 인도네시아 시험 검사(허가 기관 중)기관에 해당 의무 검사 항목(필수 1회)을 포함해 성적서를 제출해야 하는데 이 때 이 범위에 들지 못하는 결과치가 나올 경우 나올 때까지 무한 반복 검사를 받아 제출돼야 최종 승인 조건에 들 수 있다. 이런 문제로 필자는 그간의 업무 경험으로 인도네시아 시험 검사기관에서 먼저 사전 검사를 받아 그 결과치를 비교하여 안정 보고서(Stability Report) 준비를 할 것을 제안한다.
4. 위 조건을 감안하면 제약 면허를 갖고 있는 제조사에서 해당 제품의 생산에 대한 시험 검사와 제약품에 준하는 안정 보고서(Stability Report)에 대한 시험 검사도 같이 준비돼 있다면 인도네시아 식약청에 제품 등록 접수 시 3~4개월 내에도 충분히 가능하다고 필자는 생각한다. 물론 이는 인증 위임업체의 역량의 영향에 따라 달라질 수 있다. 다만, 한국의 제조산업의 구조상 제품의 초고속 등록은 현실적으로 불가능할지도 모른다. 그렇기 때문에 건강보조식품과 전통 의약품 수출 준비에 있어 사전에 한국 정부 산하 지원기관과 함께 인증 전문가의 도움을 받아 준비하는 것도 좋을 것으로 생각된다.
이게 끝이 아닌 인도네시아 비관세 장벽
1. 지금까지의 설명은 인도네시아 수출과 현지 유통을 위하여 사전 등록 허가제인 인도네시아 식약청(BPOM) 등록 허가 요건에 대해 소개했다. 본 제품의 허가가 완료 후에는 해당 제품의 유형은 인도네시아 수출 이전 선전적 사전 검사제도인 LS(Laporan Surveyor, Request for Inspection)라는 제도가 있어 한국에서 제품의 선적 준비 전 인도네시아 수입회사가 해당 기관에 신청하면 한국 지정 대리기관(주로 SGS 한국)에서 현장 방문해 확인 절차 후 서류를 발급해 준다. 이후 출항해 인도네시아에 도착된 화물만이 통관될 수 있는 조건임도 주의가 필요하다.
선적전 검사 사항은 주로 수입업체에서 준비해야 하는 문제이나 간혹 수입사가 사전 정보의 부재로 선적전 검사 없이 수출이 돼 인도네시아 항만에 도착할 경우 통관이 불가한 문제로 거래 마찰과 클레임이 발생할 수 있음에 주의가 필요하다.
2. 인도네시아 수입사는 SKI(Surat Ketrangan Impor)라는 수입 유통 신고서를 해당 관청이 식약청에 별도로 제품의 수입시마다 신고해 유통 허가서를 받아야 한다. 보통은 신청 후 3일 내 발급되는 서류이다. 한국의 수출 제조사는 SKI 발급을 위해 해당 제품의 COA를 수입업자를 통해 인도네시아 식약청에 제공해 주어야 한다. COA가 누락이 된다면 SKI 발급이 되지 않기 때문에 이 COA를 반드시 잊지 말아야 한다. 또한 건강보조식품 및 전통의약품 등급에서 요구되는 의무 시험검사 항목이 충족돼야 함도 중요하다. 이때 COA는 제조사에서 발행 문서이다.
성공적인 준비와 사업적 기대치
인도네시아의 현재 소비 트렌드가 먹고 사는 생존의 문제를 떠나 건강을 우선하는 풍조로 변화하고 있다. 그렇기 때문에 제품을 수입, 유통 조건에 부합하는 서류 및 진행 과정에 대비를 한다면 진성 바이어 발굴이 어렵지는 않을 것이다. 특히 건강기능식품과 전통의약품의 인증은 받기가 까다로운 편이다보니 해당 제품 시장의 경쟁이 치열하지 않다. 그렇기 때문에 제대로 준비된 제품은 유리한 고지를 선점하기가 쉬울 것이고, 제품을 유통시키기 위한 합법적인 허가 취득은 인도네시아 시장 개척의 발판이 될 것이다.
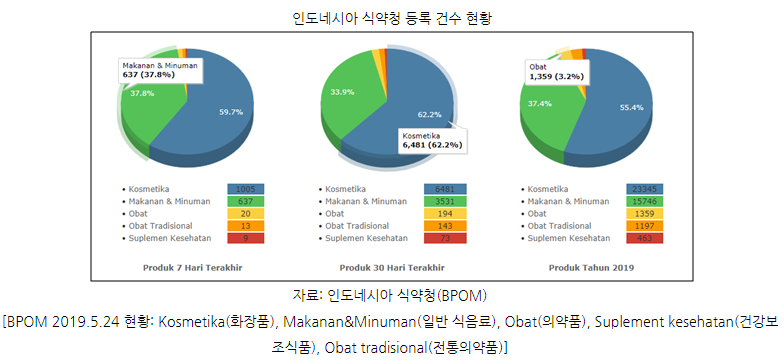
인도네시아 식약청 등록 건수 현황 통계자료에 따르면 인도네시아 기업뿐만 아니라 등록 허가 요건을 맞추기 어렵고 준비에 비용과 시간적 소요로 국내외 제품이 적은 비중으로 등록돼 있는 것은 사실이다. 이는 BPOM 등록 절차가 까다로운 것을 암시하기도 하나 발상의 전환을 통해 이런 점을 전략적 차원에서 잘 활용한다면 충분히 우리 기업에도 인도네시아 건강보조식품 및 전통의약품 시장은 기회가 될 수 있을 것이라고 생각한다.
※ 해당 원고는 외부 전문가가 작성한 정보로, KOTRA 공식의견이 아님을 알려드립니다.
< 저작권자 ⓒ KOTRA & KOTRA 해외시장뉴스 >



















